【化学結合論】たのしむ、分子軌道法。【HMO⑥】
本日も、りけいのりがお届けします。
分子軌道法について扱って6回目の記事にして、ようやく化学結合論に関与する分子軌道法の内容を取り扱います。特に、今回の記事から、
- 結合性軌道 (Bonding Molecular Orbital)
- 反結合性軌道 (Antibonding Molecular Orbital)
の成り立ちを理解することができます。また、化学結合の妥当性を数学的に考えることができるようになります。
本日扱う内容には、線形代数のテクニックも含まれますが、学んだことの無い方は飛ばし読みでもOKです。
前提として確認したいのが、"ヒュッケル近似はπ共役系に関する分子軌道の導出を与える"、ということです。この文章、ピンと来ない方は、前回の記事を参照して下さい。
20世紀の天才が考えた、非常に精巧な論理の旅路に、出発しましょう!!

ヒュッケル近似に登場する用語の説明
まずはじめに、ヒュッケル近似に登場する用語についての説明です。前回の記事では、積分に関する様々なパラメータが登場してきました。ここでは、以下のような命名に従います。

それぞれの意味については以下で説明します。ここで注目したいのは、いずれのパラメータの名前にも"積分"という単語が含まれることにあります。すなわち、クーロン積分、共鳴積分、重なり積分は単なる文字ではなくて、物理的な意味が存在するということです。
まずはじめに、クーロン積分から扱います。
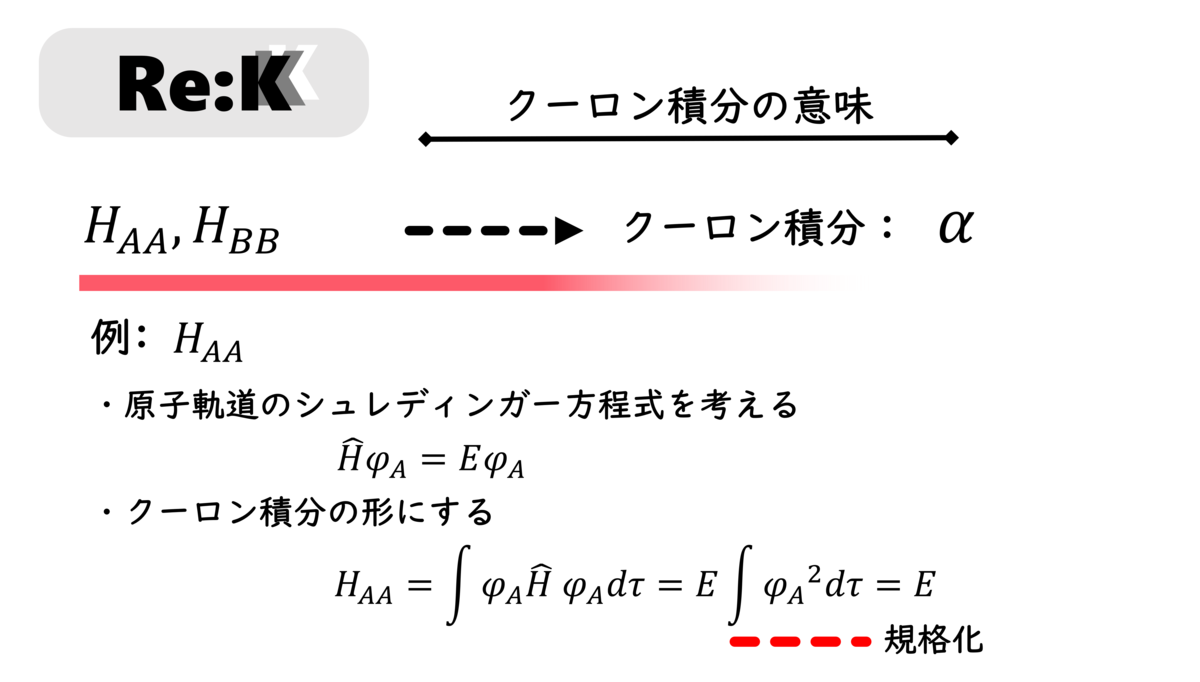
ここで、クーロン積分は、エネルギーの次元(単位)を持ちます。何かのエネルギーに相当するということです。では、何のエネルギーなのでしょうか。
それは、π共役系を構成する原子が結合を形成していない (原子核同士が無限遠に位置する)時の、p軌道中に存在する電子のエネルギーとなります。それは、上図のようにして証明できます。αは約-7eVをとります1)。αが負である理由は、原子核からのポテンシャルエネルギーに由来する、電子の安定化効果が反映されているためです。
続いて、共鳴積分についてです。

共鳴積分は、p軌道同士の相互作用により生じるπ共役系の形成に伴う、エネルギーの変化を反映しています。特に、電子の非局在化は、電子の示す全エネルギーを安定化させるので、βはやはり負の値 (約-3eV1))をとります。
π共役系が大きくなるほど、すなわち共役したπ結合の数だけ、安定化効果も大きくなります。
続いて、重なり積分についてです。

重なり積分は、原子軌道同士の重なりを示しています。例えば、全く同じ原子軌道の化さなり積分は、座標が同じであれば完全に重なるので、積分値は1を示します。
一方、原子軌道が全く重なっていない場合は、一方の波動関数が有限の値を示しても、もう一方の波動関数が0の値をとることから、積分値は0となります。
原子軌道間で少しの重なりがある場合、積分値は1より小さく0より大きな値を示します。
以上、クーロン積分、共鳴積分、重なり積分について紹介しました。続いて、ヒュッケル近似の説明とシュレディンガー方程式への適用を試みます。
シュレディンガー方程式へのヒュッケル近似の適用
ヒュッケル近似の内容は、次の通りです。

・共鳴積分に関して...
- 隣接原子の場合:p軌道間の相互作用は大きいことから、共鳴積分は有限の値βをとり、分子軌道を安定化させる
- 隣接しない原子の場合:p軌道間の相互作用は小さいことから、共鳴積分は無視でき、よって0と近似する。
・重なり積分に関して...
- 同一原子の場合:自身と同一の軌道との重なりは定義より1
- 異なる原子の場合:自身と異なる軌道との重なりを0と近似する。
以上のように、共鳴積分、重なり積分に対して、それぞれ0に近似する操作が登場します。そんなことしてしまって良いの? と思われるかもしれません。厳密解を求める場合にはまずいですね。
しかし、このような大胆な仮定を置くことで、分子軌道を手計算でも求められるようになり、また分子軌道に関する数多くの知見を与えてくれるのです。化学結合論の学習上、有益であるといえるでしょう。
それでは、ヒュッケル近似を、前回の記事にて得られた2本の方程式に適用します。

すると、ずいぶん単純な連立方程式が導かれました。次への誘導のため、線形代数的にも表現します。
ここで重要な点は、cAおよびcBが0であってはならないということです。cAおよびcBはもともと、分子軌道のLCAO近似をした際に生じた係数(定数)でした。
これらが0になってしまうと、そもそも物理的に意味を持たない分子軌道が得られてしまいます。これでは困るわけです。
そこで、先ほど得られた連立方程式を表す行列を考えます。

cAおよびcB がそれぞれ0でない解を求めるために、線形代数のテクニックを使います。具体的には、行列式の値が0である時 (行列が正則でないとき)、cAおよびcBは0以外の値もとれるようになります。
この操作により得られる方程式を、永年方程式と呼びます。かっこよすぎます。
では、この方程式を解いてみましょう。

永年方程式の解と各積分値間の関係
以上より、電子の取りうる全エネルギーの条件が、クーロン積分および共鳴積分より求まりました。前述の通り、クーロン積分および共鳴積分は、ある決まった値をとるので、分子軌道に属する電子のエネルギーを求められたことになります。大収穫です。
では、分子軌道のエネルギーをエネルギー図に略記します。

2つの原子軌道が相互作用をすることで、新たに2つの分子軌道が生じました。原子核同士が無限遠に離れていた時と比較して、2βの安定化エネルギーを獲得しています。
これは、p軌道間のπ結合(化学結合)を起こすことが、分子に安定化の効果をもたらすことを示しています。化学結合論の真髄です。
ここから、さらに踏み込みます。得られた分子軌道のエネルギーを基に、LCAO近似での係数間の関係を求めます。

続いて、係数に関する等式を、LCAO近似における分子軌道の定義式に代入します。

すると、2つの分子軌道に関する方程式が導かれました。ここで復習したいのが、
- φは原子軌道 (波動関数) を示す。
ということです。そして、原子軌道φの線形結合によって分子軌道ψを求めたのでした。ここで重要となるのが、係数の正負です。cAを正にとると、ψ1、ψ2に関して、それぞれ波動関数の重ね合わせが成立します。
ここでの符号を位相、符号が一致することを同位相、符号が異なることを逆位相といいます。いずれも、数学的な背景から導かれることが分かったと思います。

同位相では、波動関数の和をとるとより大きな値を有する波動関数が導かれます。ボルンの解釈から、波動関数の2乗が軌道に存在する電子の確立密度分布を示します。よって、2つの原子間に存在する電子の存在確率密度は、結合を生成することで(分子軌道を生成することで)大きくなります。
結合性軌道の誕生です。

逆位相では、波動関数の和をとると原子間に0の値を有する波動関数が導かれます。この空間は、節 (せつ) と呼び、電子が存在できない領域となります。これはすなわち、原子間の結合を切断するような、電子の存在確率密度分布をとるということです。
反結合性軌道の誕生です。
では最後に、得られた2つの分子軌道 (結合性軌道、反結合性軌道)の輪郭表示を見てみましょう。

輪郭表示とは、電子がその空間内に一定の割合で含まれることを示した図となります。分子中、どこに電子が存在しているのかを表しているともいえるでしょう。
おわりに
これで、古典力学から分子軌道法までの化学結合論の旅は、無事に終了です。化学系の学生を苦しめる化学結合論には、古典力学、量子力学、微分積分学、線形代数学など様々な学問の素養が必要となります。これが、化学結合の本質を理解する上で、大きく高いハードルとなっています。
一方、量子化学計算は、今回までに紹介した思考プロセスの産物であり、これからの化学観を大きく変えるポテンシャルを秘めています。創薬や機能性材料の探索など、今や化学系にとっては欠かせない技術です。
分子軌道論の理解には、一定以上の期間を要します。焦らず急がず、また分からなくなったら、ここに戻ってきて復習をしてみて下さい。
ここまで全6回の分子軌道法に関する記事、お付き合い頂きありがとうございました。
以上、りけいのりがお届けしました。
○2022年のお知らせ
りけいのりの中の人が、YouTubeチャンネルを開設しました!
りけい大学院生の日常や考えていることを共有していきます!!
記事の内容も動画にて再度取り上げる予定ですので、ぜひお立ち寄りください!!!
参考文献
1) 井本稔 (2001), 有機電子論解説 第4版 第9刷, 株式会社 東京化学同人, 14 分子軌道法-HMO.
2) Dr. Ian Hunt, Department of Chemistry, University of Calgary, Accessed: 2020/10/14.
