【化学結合論】わかる、分子軌道法。【HMO③】
本日も、りけいのりがお届けします。
前回の記事までに、分子軌道法を学ぶ上で重要な
を行ってきました。本記事では、これらを基礎として、分子軌道法の核心に迫ります。
前回の記事をお読みでない方は、こちらからご覧ください。
今回は、数学的な操作がいくつか登場しますが、なるべく平易に説明します。
安心してご覧ください。
特に、今回扱うのは、単純ヒュッケル法と呼ばれる、分子軌道法です。化学結合を分子軌道法に基づいて厳密に計算する場合、Schrodinger方程式と呼ばれる量子力学の基礎法的式を解く必要があります。しかし、物理学において3つ以上の物体に関する運動を記述することは、できないとされています (多体問題)。
そこで、様々な近似を用いて、できるだけ実情を再現するようなモデルを確立することが重要になります。今回扱う単純ヒュッケル法も、ヒュッケル近似と呼ばれる近似概念を取り入れます。
まずは、シュレディンガー方程式に関する簡単な説明からスタートします。次回の記事より、ヒュッケル近似について取り扱います。

シュレディンガー方程式について
まずは、量子力学の基礎方程式である、シュレディンガー方程式についてお話します。

シュレディンガー方程式は微分方程式です。微分方程式は、方程式の解が関数により与えられるのが特徴です。(なじみのある方程式を解く際には、ある値を求めることが命題でした)
今回示した、シュレディンガー方程式は、特に時間に依存しない (定常状態) シュレディンガー方程式です。時間に依存するシュレディンガー方程式を求める場合は、以上の方程式を解いて得られた波動関数に、時間依存項の関数を乗じます。また、このシュレディンガー方程式は、簡単のために次元を1次元としています。
よって、この方程式を解くことで、波動関数と呼ばれる関数を得たい、ということになります。この関数を得ることで、いったい何がしたいのでしょうか。
そのためには、波動関数の持つ意味について説明する必要があります。今回は、詳しいことは省略し、結論から述べます。波動関数の二乗は、量子の存在確立密度を示すということです (超重要)。
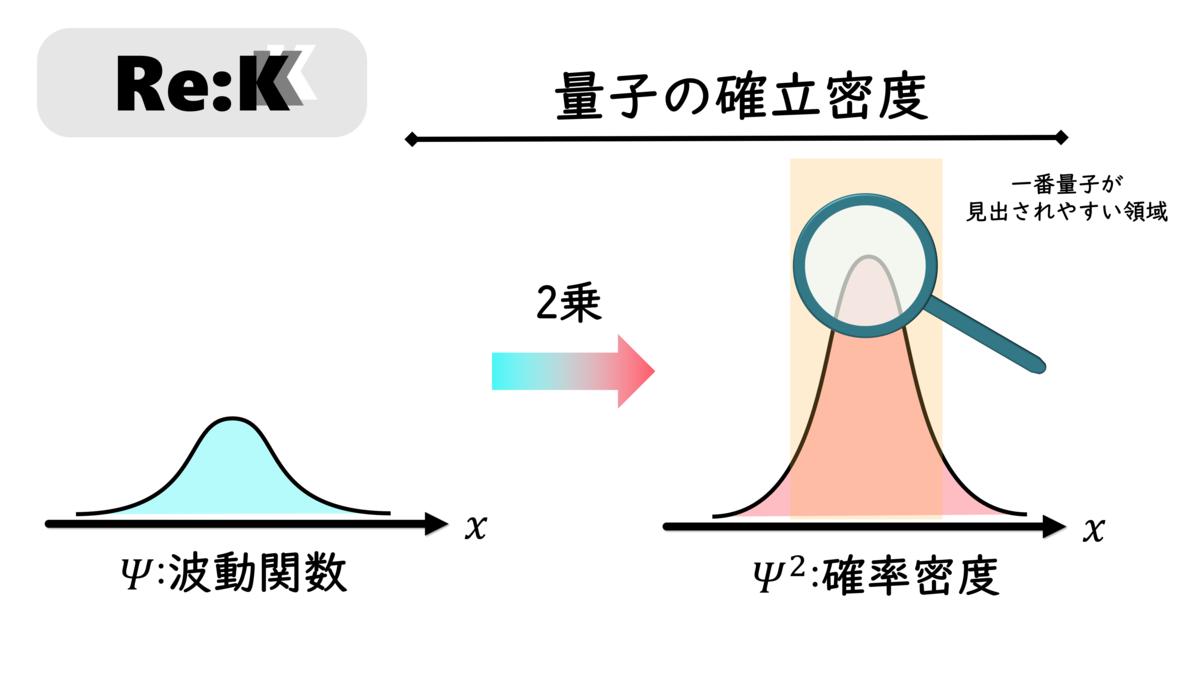
"波動関数の二乗は、量子の存在確立密度を示す"という量子力学的な解釈は、発見者の名に因んでボルンの解釈と呼ばれています1)。
ここで、話を第一回の記事【HMO①】に戻します。

古典力学的には、クーロン力によって荷電粒子である電子が、原子核近傍に存在することを、既に説明しました。この電子が収容されている空間を、軌道と呼びます。高校化学を学んだことのある人にはお馴染みです。
何故、"軌道"という名前がついたのかというと、その数学的表現が惑星の軌道のそれと似ていたからだそうです。
そして、先ほどシュレディンガー方程式を解くことで求めた波動関数こそが軌道の正体です。量子の軌道には、前回の記事でお話した離散性が関与します。よって、量子数によって軌道は姿かたちを変え、s軌道やp軌道、d軌道と様々な姿になります。以下に、厳密な計算から求められた、電子の軌道の様子を示します。

対称性に富んだ、美しい形をしています。
以上の議論を経て、量子力学的に化学結合を記述できるようになりました。少し難しい内容が続きますが、ここが踏ん張りどころです!!
化学結合を数式で表したい
ここでは、簡単のために時間に依存しない一次元のシュレディンガー方程式により得られた解を考えます。2つの原子に属する電子の軌道は、以下のように交わることができます。

ここで、波動関数 (軌道)という名の通り、量子は波の性質も有しています。これを、量子における"波と粒子の二重性"といいます。波は、互いに干渉することで、強め合ったり弱めあったりします。特に、今回の場合は強め合い、以下のような新たな軌道を生成します。

この新たな軌道こそが、分子軌道です。 特に、2つの波動関数が互いに干渉することで、ψA-Bの中ほどの値が増大していることが分かります。これはすなわち、2つの原子間に存在する電子の存在確立が増大したことを示しており、つまり分子軌道の生成により化学結合が生成しているのです。
以上のような分子軌道を、化学結合に関与する分子軌道であることから、結合性軌道といいます。他にも、軌道の開裂に関与する反結合性軌道が存在しますが、また別の機会に扱います。
おわりに
だいぶ込み入った話が続きました。新しい概念が続々と出てきて、頭が混乱しますよね。りけいのりも、学習当初は何を言っているのか、全く分かりませんでした。
何度も、この記事や、他の参考文献を反復して読むことで、少しずつ理解していただけたらと思います。次回の記事より、ヒュッケル近似による、分子軌道の詳細な解説に移行します。
以上、りけいのりがお届けしました。
参考文献
1) P. Atkins, J. de Paula, D. Smith (2013) Elements of Physical Chemistry 6th Edition, 訳書 アトキンス 物理化学要論 (第6版), 訳) 千葉秀昭, 稲葉章, 株式会社東京化学同人, 12. 量子論.
2) 奥山格, 石井昭彦, 箕浦真生 (2016), 有機化学 改訂2版, 丸善出版株式会社, 1 化学結合と分子の成り立ち.
3) Orbital Shapes EWT, Accessed: 2020/10/08.

